1.目的
保障受試者人身安全和權(quán)益,做好臨床試驗(yàn)的安全性管理工作。
2.適用范圍
適用于臨床試驗(yàn)中發(fā)生的不良事件(AE)、嚴(yán)重不良事件(SAE)和非預(yù)期事件。
3.規(guī)程
3.1 管理職責(zé)
3.1.1 本機(jī)構(gòu)主要研究者總體負(fù)責(zé)臨床試驗(yàn)項(xiàng)目AE、SAE和非預(yù)期事件的管理,有義務(wù)采取必要的措施以保障受試者的安全,并記錄和報(bào)告。
3.1.2 機(jī)構(gòu)辦公室、倫理委員會和HRPP進(jìn)行監(jiān)督管理。
3.2 管理要點(diǎn)
3.2.1 研究者有義務(wù)采取必要的措施以保障受試者的安全,在臨床試驗(yàn)過程中如發(fā)生AE、SAE和非預(yù)期事件,研究者應(yīng)立即對受試者采取適當(dāng)?shù)拇胧员U鲜茉囌叩陌踩?
3.2.2 研究者應(yīng)及時(shí)記錄,不得有任何隱瞞或虛報(bào);同時(shí)向申辦者、機(jī)構(gòu)辦公室、倫理委員會和HRPP報(bào)告。
3.2.3 研究者應(yīng)對受試者在試驗(yàn)期間所發(fā)生的AE、SAE和非預(yù)期事件作出相應(yīng)評估,判斷與試驗(yàn)藥物之間的關(guān)系,判斷不良事件或非預(yù)期事件的嚴(yán)重程度。
3.2 需要報(bào)告的AE和非預(yù)期事件
(1)SAE;
(2)任何可能將受試者暴露在潛在風(fēng)險(xiǎn)之下的非預(yù)期事件;
(3)任何可能將受試者之外的人群(如研究者、研究者助理、公眾等)暴露在潛在風(fēng)險(xiǎn)之下的非預(yù)期事件;
(4)額外信息提示研究的風(fēng)險(xiǎn)獲益發(fā)生了改變。如研究的中期分析或安全委員會提示研究的風(fēng)險(xiǎn)獲益發(fā)生了改變,或者其他的類似研究發(fā)表文獻(xiàn)提示研究的風(fēng)險(xiǎn)獲益發(fā)生了改變;
(5)違反了保密條款;
(6)為了解決受試者的緊急情況,而在倫理委員會審查同意之前就對方案做了修改;
(7)傷害了受試者或者存在潛在傷害風(fēng)險(xiǎn)的方案違背;
(8)申辦方因?yàn)轱L(fēng)險(xiǎn)原因暫停試驗(yàn)。
3.3 報(bào)告時(shí)限
|
本中心發(fā)生的 |
報(bào)告時(shí)限 |
|
非預(yù)期事件(不包括SAE) |
首次獲知后24小時(shí)內(nèi)報(bào)告 |
|
SAE(除外致死或危及生命的SUSAR) |
首次獲知后24小時(shí)內(nèi)報(bào)告 |
|
致死或危及生命的SUSAR |
首次獲知后立即報(bào)告 |
|
本中心發(fā)生的和其他中心發(fā)生的 |
報(bào)告時(shí)限 |
|
非致死或危及生命的SUSAR1 |
盡快報(bào)告,但不得超過首次獲知后15天。(首次獲知當(dāng)天為第0天) |
|
致死或危及生命的SUSAR1 |
盡快報(bào)告,但不得超過首次獲知后7天,并在隨后的8天內(nèi)報(bào)告、完善隨訪信息。 |
注1:本中心發(fā)生的SUSAR,需要遞交本中心SAE首次報(bào)告后的補(bǔ)充資料。
3.4 報(bào)告
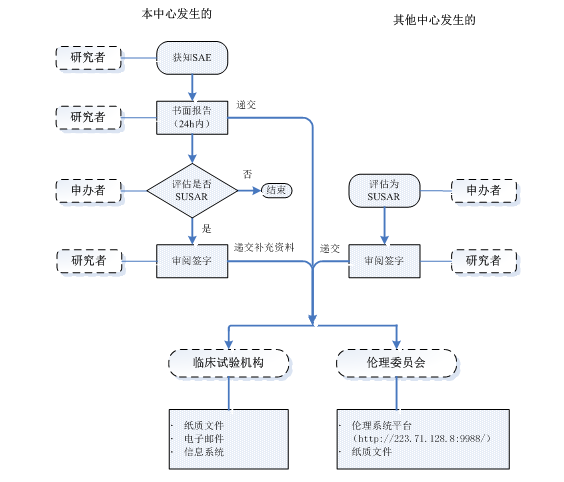
3.4.1 本中心發(fā)生3.2所述需要報(bào)告的SAE/非預(yù)期事件(除外試驗(yàn)方案或者其他文件(如研究者手冊)中規(guī)定不需立即報(bào)告的SAE),研究者在獲知受試者出現(xiàn) SAE 時(shí),應(yīng)立即通知本中心主要研究者(PI)、藥物臨床試驗(yàn)機(jī)構(gòu)辦公室SAE專員和申辦者;并在24小時(shí)內(nèi)向申辦者提供書面報(bào)告(除非在研究方案中另有約定);同時(shí)按3.3所述時(shí)限報(bào)告本中心倫理委員會辦公室。如果申辦者分析評估后確定為SUSAR, 研究者收到后應(yīng)當(dāng)及時(shí)審閱簽字,并向機(jī)構(gòu)辦公室和倫理委員會辦公室遞交本中心SAE首次報(bào)告后的補(bǔ)充資料,報(bào)告時(shí)限按3.3所述。SAE/SUSAR報(bào)告流程如下圖(含首次、隨訪、總結(jié)報(bào)告)。
3.4.2 其他中心發(fā)生的可疑且非預(yù)期嚴(yán)重不良反應(yīng)(SUSAR),只要涉及的項(xiàng)目同時(shí)在本中心開展,均應(yīng)快速報(bào)告給本中心研究者,研究者及時(shí)審閱簽署SUSAR報(bào)告;研究者(或者申辦者)應(yīng)向本院臨床試驗(yàn)機(jī)構(gòu)和倫理委員辦公室會遞交SUSAR報(bào)告,報(bào)告時(shí)限按3.3所述,所有遞交的SUSAR報(bào)告均需經(jīng)研究者審閱簽字。SAE/SUSAR報(bào)告流程如下圖(含首次、隨訪、總結(jié)報(bào)告)。
3.4.3 研發(fā)期間安全性更新(DSUR)報(bào)告,依據(jù)申辦者工作流程自行擬定。
3.4.4 其余非預(yù)期不良事件在年度/定期跟蹤審查報(bào)告或研究完成報(bào)告中向倫理委員會辦公室報(bào)告。
3.4.5 上市后臨床試驗(yàn)中發(fā)生的SAE或新的不良事件,應(yīng)同時(shí)報(bào)告國家藥品不良反應(yīng)監(jiān)測中心。
SAE/SUSAR報(bào)告流程圖:
3.5 倫理委員會審查
3.5.1 倫理委員會受理后,首先確定是否需要召開緊急會議審查,如研究過程中出現(xiàn)重大或嚴(yán)重問題,危及受試者安全的情況,經(jīng)主任委員決定后,召開緊急會議。
3.5.2 按倫理委員會審查流程進(jìn)行SAE/非預(yù)期事件審查,倫理委員會根據(jù)安全性風(fēng)險(xiǎn)嚴(yán)重程度,可能要求研究者和申辦者加強(qiáng)風(fēng)險(xiǎn)控制措施,如調(diào)整臨床試驗(yàn)方案、知情同意書、研究者手冊,必要時(shí)可要求暫停或者終止臨床試驗(yàn)。以上意見倫理委員會辦公室除了向研究者傳達(dá)外,還應(yīng)向機(jī)構(gòu)辦公室、HRPP傳達(dá)。
3.5.3 倫理委員會應(yīng)對后續(xù)處理情況進(jìn)行跟蹤審查。
4. 名詞
4.1不良事件(Adverse Event, AE):病人或臨床試驗(yàn)受試者接受一種藥品后出現(xiàn)的不良醫(yī)學(xué)事件,但并不一定與治療有因果關(guān)系。
4.2 嚴(yán)重不良事件(Serious Adverse Event, SAE):臨床試驗(yàn)過程中發(fā)生需住院治療、延長住院時(shí)間、傷殘、影響工作能力、危及生命或死亡、導(dǎo)致先天畸形等事件。
4.3 非預(yù)期不良事件(Unexpected Adverse Event):不良事件的性質(zhì)、嚴(yán)重程度或頻度,不同于先前方案或其他相關(guān)資料(如研究者手冊、藥品說明)所描述的預(yù)期風(fēng)險(xiǎn)。
4.4 預(yù)期的嚴(yán)重不良事件(Expected Serious Adverse Event, ESAE):申請人可預(yù)見的、在研究中的一般患者人群和某種疾病的患者(或兩者兼有)以一定頻率發(fā)生(不依賴于受試藥物的暴露)的嚴(yán)重不良事件。
4.5 藥品不良反應(yīng)(Adverse Drug Reaction, ADR):ICH GCP對于已上市藥品和未上市藥品有所不同:在一個(gè)新的藥品或藥品的新用途在批準(zhǔn)之前的臨床實(shí)踐,尤其是治療劑量尚未確定前,ADR 是指與藥物任何劑量有關(guān)的所有有害的和非意求的反應(yīng)都應(yīng)被考慮為藥物不良反應(yīng)。該術(shù)語用于藥品是指在藥品與不良反應(yīng)之間的因果關(guān)系至少有一個(gè)合理的可能性,即不能排除這種關(guān)系;對已上市藥品,ADR 僅指對用于預(yù)防、診斷或治療疾病或改善生理功能的藥物在常用劑量下出現(xiàn)的有害和非意求反應(yīng)。
4.6 非預(yù)期藥品不良反應(yīng)(Unexpected Adverse Drug Reaction, UADR):指一種藥品不良反應(yīng),其性質(zhì)、嚴(yán)重程度或頻度,不同于先前方案或其他相關(guān)資料(如研究者手冊、藥品說明)所描述的預(yù)期風(fēng)險(xiǎn)。非預(yù)期,指一個(gè)事件比研究者手冊中描述的更特殊、更嚴(yán)重,更特殊如急性腎衰后出現(xiàn)間質(zhì)性腎炎,更嚴(yán)重如首發(fā)為重型肝炎的肝炎。
4.7 可疑且非預(yù)期嚴(yán)重不良反應(yīng)(Suspected Unexpected Serious Adverse Reaction, SUSAR):指臨床表現(xiàn)的性質(zhì)和嚴(yán)重程度超出了試驗(yàn)藥物研究者手冊、已上市藥品的說明書或者產(chǎn)品特性摘要等已有資料信息的可疑并且非預(yù)期的嚴(yán)重不良反應(yīng)。
4.8 重要不良事件(Severe Adverse Event):在用藥過程中發(fā)生的不良事件和血液學(xué)或其他實(shí)驗(yàn)室檢查明顯異常,并且這些不良事件和血液學(xué)或其他實(shí)驗(yàn)室檢查明顯異常必須采取針對性的醫(yī)療措施才能恢復(fù)正常。5.參考依據(jù)
《藥物臨床試驗(yàn)質(zhì)量管理規(guī)范》
6.附件
無。